Введение
Магнитно-чувствительные наносистемы являются одними из наиболее быстро развивающихся тем в современной нанотехнологии и нанонауке. Восприимчивость таких систем к внешним физическим стимулам позволяет применять их в различных областях – от электроники и микрофлюидики до оптики и биомедицины [1]. Последняя, вероятно, является наиболее распространённой областью исследований из-за возможного применения магнитных наноматериалов для диагностики в качестве МРТ контрастные вещества, биосенсоры, магнитно-направленная доставка лекарств или другие биологические приложения, где наносистемы могут извлечь большую выгоду из магнитных свойств [2]. Стратегии применения таких систем могут подразумевать не только магнитную концентрацию или магнитно-управляемое движение биоактивных носителей, но и также магнитно-индуцированный нагрев, который можно использовать для магнитной гипертермии рака или изменения биологической активности различных систем как in vitro, так и in vivo. Принимая во внимание обзор литературы, можно сделать вывод, что современные тенденции направлены на несколько ключевых аспектов таких систем.
Существуют многочисленные синтетические стратегии, ведущие к стабильным магнитным агрегатам. Во-первых, подходящие агрегаты могут быть получены полимеризацией органических предшественников в присутствии магнитных наночастиц [3-6], что приводит к образованию магнитно-легированных гибридных частиц. Альтернативно, магнитные кластеры синтезируются in situ в автоклавах с использованием полиолов в качестве растворителей [7-9] или с помощью золь-гель процедур с предшественниками кремнезема [10-12]. Эти методы позволяют создавать широкий спектр магнитных шариков с узким распределением по размерам и высокой коллоидной стабильностью. которые в определенных условиях даже могут образовывать регулярные периодические структуры с фотонными свойствами [12]. Несмотря на удобство, описанные процедуры также имеют некоторые общие ограничения, такие как применение токсичных компонентов и ограниченные возможности для изменения структуры или пост-синтетической модификации полученных агрегатов, и в большинстве случаев подразумевают жесткие условия синтеза, поэтому внедрение современных подходов мягкой химии может быть привлекательной альтернативой.
В качестве альтернативы может применяться метод послойной самосборки. Этот процесс подразумевает последующее осаждение противоположно заряженных макромолекул на подходящие подложки для получения слоистой структуры с точно контролируемой толщиной и свойствами. Этот универсальный подход использовался для создания различных составов для доставки лекарств с магнитным нацеливанием или способностью к магнитному индуцированию, но изменчивость синтетических условий и управляемость синтетических условий дает широкие возможности для создания многофункциональных биоактивных систем, обращаясь к все вышеупомянутые проблемы магнитных биоактивных материалов.
В этой работе мы описываем применение метода послойного осаждения полиэлектролитов для производства высокомагнитных биосовместимых агрегатов с узким распределением по размерам для многоцелевых биомедицинских применений. Наша мотивация заключалась в том, чтобы использовать только биосовместимые компоненты, чтобы увеличить перспективы применения и их пригодность в качестве основы для производных систем. Мы использовали стабильные гидрозоли исходных наночастиц магнетита, чтобы гарантировать отсутствие каких-либо нежелательных поверхностно-активных веществ или посторонних молекул для формирования ядра-оболочки. Послойный подход синтеза оболочек обеспечил простой способ формирования агрегатов с наноразмерным контролем толщины покрытия и конечного диаметра частиц. Полученные материалы показали превосходную коллоидную стабильность и вели себя как магнитные фотонные кристаллы под воздействием внешнего магнитного поля. Исследовано влияние состава оболочки на физические, оптические и биологические свойства.
Экспериментальная часть
Химические вещества: тетрагидрат хлорида железа (II), гексагидрат хлорида железа (III), цитрат натрия, ацетат натрия, этиленгликоль, диэтиленгликоль, водный раствор аммиака, гепарин, полистиролсульфонат (PSS), поли(диаллил)хлориддиметиламмония) (PDADMAC), полиакриловая кислота (PAA), полиэтиленимин (PEI), хлорид полиалкиламина (PAH), этанол 99%, порошок тиазолилового синего тетразолия (MTT) и диметилсульфоксид (DMSO), человеческий сывороточный альбумин (HSA), Раствор Рингера, полученный от Sigma Aldrich и использованный без дальнейшей очистки. Среда EMEM, гентамицин (50 мкг/мл) и раствор Версена были от Biolot. Тромбин (500 ед.) и антитромбин III (150 ед.) были получены от Техстандарт и растворены в растворе Рингера до конечной концентрации 50 ед./мл. FBS был получен от HyClone Laboratories. Таблетки с фосфатным буферным раствором (PBS) были приобретены у Gibco. Деионизированную воду (15 МОм) получали с использованием системы Merck Millipore Elix 3.
Гидрозоль магнетита: Стабильный гидрозоль магнетита получали по методике, описанной ранее [13-14]. Вкратце, 2,5 г FeCl2* 4H2O и 5 г FeCl3 * 6H2O растворяли в 100 мл деионизированной и деаэрированной воды. Затем добавляли 12 мл водного раствора аммиака при постоянном перемешивании (500 об/мин) при комнатной температуре. Образовавшийся осадок магнетита магнитно отделяли и промывали деионизированной и деаэрированной водой до нейтрального значения рН. Промытый черный осадок смешивали с 100 мл деионизированной и деаэрированной воды и подвергали ультразвуковой обработке (37 кГц, 110 Вт) при постоянном перемешивании (300 об / мин). Полученная массовая концентрация гидрозоля магнетита составила 2%.
Послойное покрытие наночастиц магнетита полиэлектролитами: Один миллилитр стабильного гидрозоля магнетита смешивали с 1 мл раствора, содержащего 2 мг / мл отрицательно заряженного полиэлектролита (PSS, PAA или гепарин) в 0,2 М NaCl. Смесь обрабатывали ультразвуком в течение 30 минут и разделяли центрифугированием с последующей промывкой деионизированной водой три раза. Полученные агрегаты ресуспендировали в 1 мл воды и смешивали с 1 мл 2 мг/мл раствора положительно заряженного полиэлектролита (PEI, PDADMAC или PAH) в 0,2 М NaCl. Смесь обрабатывали ультразвуком в течение 30 минут и разделяли центрифугированием с последующей промывкой деионизированной водой три раза. После этого добавляли смесь 1 мл раствора гепарина с концентрацией 2 мг / мл и 1 мл 0,2 М раствора NaCl и смесь обрабатывали ультразвуком в течение 20 минут. Полученные гепаринизированные агрегаты отделяли центрифугированием и промывали смесью этанол-вода (соотношение 3:1). Полученный материал диспергировали в воде до конечной концентрации 20 мг/мл.
Оценка активности гепарина: количество адсорбированного гепарина и присутствие гепарина в промывных водах оценивали с помощью анализа анти-Ха активности [15]. До 100 мкл тестируемого образца, 33 мкл контрольной плазмы, 33 мкл антитромбина III (ATIII) раствор и 133 мкл раствора PBS. К полученной смеси добавляли 200 мкл раствора фактора Ха с последующей инкубацией в течение 5 минут при 37 °С. После инкубации добавляли 200 мкл раствора хромогенного субстрата и смесь инкубировали в течение дополнительных 5 мин при 37 °С. Затем добавляли 400% 50%-ной уксусной кислоты и измеряли оптическую плотность при 405 нм.
Методы анализа: ИК-ATR спектры регистрировали на спектрометре FTIR Perkin-Elmer System 2000 с использованием аксессуара Heated Golden Gate ATR (продукт SPECAC) с алмазным кристаллом ATR, используя линзы с одним отражателем и фокусировкой ZnSe. Гидродинамический диаметр и дзета-потенциал измеряли с помощью DLS с использованием Photocor Compact Z. Образцы для просвечивающей электронной микроскопии (ПЭМ) были получены на FEI Titan, Для сканирующей электронной микроскопии (SEM) полученные образцы высушивали в вакууме в течение одного часа и исследовали с помощью Tescan VEGA 3.
Результаты и обсуждение
Синтез агрегатов
Магнитные агрегаты были изготовлены в виде последовательных этапов: синтез стабильных в воде наночастиц магнетита, предназначенных для использования в качестве ядер, и самосборка магнитно-фотонных кристаллов послойной техникой. На первой стадии стабильный гидрозоль магнетита синтезировали с помощью ультразвукового метода совместного осаждения [13,16]. Совместное осаждение нестехиометрической смеси хлоридов железа (II) и (III) в щелочных условиях с последующим промывка до нейтрального рН и обработка облучением США привели к образованию стабильной коллоидной системы, состоящей из наночастиц первичного магнетита, диспергированных в воде. Синтезированные наночастицы имели диаметр 10 ± 2 нм в соответствии с SEM, TEM и XRD (фиг. 1a-c) и имели положительный дзета-потенциал, оцененный +31 мВ при pH 7. Кристаллическую фазу образцов анализировали с помощью рентгеноструктурного анализа и КР-спектроскопии. Рентгенограмма образца сравнивалась с файлом JCPDS 19-0629 и показывала картину, типичную для кристаллических решеток магнетита и маггемита (рис. 1b), тогда как спектры комбинационного рассеяния образца демонстрировали интенсивный пик при 663 см-1 и отсутствие сигналов в области 600-400 см-1, доказывая, что NP имели кристаллическую фазу магнетита (рис. 1d). Исследование НЧ с помощью ИК-спектроскопии при различных температурах показало, что поверхность материала была насыщена группами Fe(II)-OH, что приводило к повышению гидрофильности материала и смещению его изоэлектрической точки в более высокие значения [17]. Коллоидная стабильность системы была настолько высокой, что она вела себя как обычная магнитная жидкость и реагировала на внешнее магнитное поле без заметного разделения фаз (рис. 1f).
Кластеризация и самоорганизация гидрозоля магнетита в магнитные агрегаты осуществлялись послойной адсорбцией полиэлектролитов. Как было показано ранее, средний размер, индекс монодисперсности и стабильность являются наиболее важными свойствами для магнитно-фотонных кристаллов, поэтому мы решили изучить влияние состава полиэлектролитов на структурные свойства образующихся агрегатов. В список протестированных полиэлектролитов вошли три анионных полимера: сильный полистиролсульфонат (PSS), природный полиэлектролит, гепарин и слабая полиакриловая кислота (PAA), а в качестве поликатионных соединений были выбраны три типа полиаминов: полиэтиленимин (PEI), поли (хлорид диаллилдиметиламмония) (PDADMAC) и хлорид полиаллиламина (ПАA).
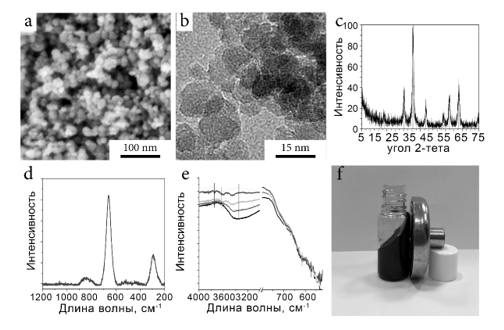
Рисунок 1: Характеристика гидрозоля. СЭМ-изображение магнетитовых наночастиц (a); ПЭМ-изображение магнетитовых наночастиц (b); Рентгенограмма наночастиц магнетита по сравнению с JCPDS 19-0629 (c); Спектры комбинационного рассеяния магнетитовых наночастиц (d); ИК-спектры наночастиц магнетита, записанные при различной температуре (e); внешний вид гидрозоля магнетита (f).
Гепарин/PDMADMAC показал наиболее подходящую комбинацию параметров, подходящих для создания фотонной системы: высокий заряд агрегатов (+34 мВ), размеры агрегатов в диапазоне диаметров, где образование магнитных фотонных кристаллов было экспериментально продемонстрировано ранее, и узкий размер распределения, что важно для формирования регулярных структур с фотонными свойствами, d)[12,18,19]. В качестве конечной стадии синтеза агрегаты были покрыты отрицательно заряженными полиэлектролитами PSS или гепарином (рис. 2b). Адсорбция сульфатированных макромолекул сместила поверхностный заряд систем до сильно отрицательных значений, дзета-потенциал конечных кластеров достигал -42 мВ для обоих полианионитов, в то время как гидродинамический радиус составлял 92 ± 11 нм и 95 ± 23 нм для PSS / PDADMAC/гепарин (PPH) и гепарин/PDADMAC/гепарин (HPH) соответственно или 90 ± 9 и 92 ± 15 для PSS/PDADMAC/PSS (PPP) и гепарин/PDADMAC/PSS (HPP).
Фотонные свойства наноагрегатов
Из-за узкого распределения по размерам, высокой коллоидной стабильности и суперпарамагнитных свойств коллоидные растворы PPH и HPH вели себя как фотонные жидкости и демонстрировали характерный синий сдвиг спектров отражения при приложении перпендикулярных магнитных полей (рис. 2а, b). Наиболее заметный эффект наблюдался для раствора PPH: будучи коричневым в расслабленных условиях, система становилась красноватой под воздействием магнитного поля и претерпела полномасштабное изменение цвета на темно-синий при увеличении напряженности магнитного поля от 0 до 650 Гс при перемещении магнит от 5 до 1 см к образцу. Пики отражения были изменены соответственно от 720 до 445 нм. Изменение цвета было быстрым и обратимым, показывая обратимый и воспроизводимый фотонный отклик и релаксацию к приложенному переменному магнитному полю с частотой 1 Гц. Заметное изменение цвета также наблюдалось для системы HPH, но интенсивность спектров отражения была почти в десять раз ниже, а изменение цвета отражения было менее резким (рис. 2b). Это наблюдение можно объяснить более широким распределением агрегатов HPH по размерам, что приводит к ухудшению качества решетки фотонных кристаллов.

Рисунок 2: Оптические свойства магнитных фотонных кристаллов. Внешний вид HPH (a) и PPH (b) при различной напряженности магнитного поля. Цвет раствора был изменен с коричневого на синий в ответ на приближающийся магнит.
Биоактивность агрегатов
Мотивация исследования заключалась в разработке синтетического подхода, основанного на самосборке полиэлектролита для формирования многофункциональных биоактивных оптических композитов, поэтому прежде всего была оценена биосовместимость синтезированных материалов. Первоначальное исследование цитотоксичности материалов проводили на клеточной линии HeLa с использованием анализа МТТ. Агрегаты инкубировали в течение 24 и 72 часов и после этого измеряли жизнеспособность клеток путем окрашивания МТТ (Рис. 3a,b). Можно видеть, что как HPH, так и PPH не вызывали каких-либо значительных цитотоксических эффектов на клетки HeLa в диапазоне концентраций 6,25-200 мкг/мл, без существенных различий между показателями выживаемости клеток при различных концентрациях, и нет морфологических признаков гибели клеток не наблюдалось. Напротив, как PPP, так и HPP проявили выраженную цитотоксичность, особенно при концентрации 200 мкг/мл, что привело к гибели клеток 94,7% и 92,8% соответственно. Можно отметить, что токсичность в основном зависела от состава внешнего слоя полиэлектролитов и показала лишь незначительную зависимость от состава внутренних слоев. Кажется, что наблюдаемая токсичность вызвана присутствием PSS, который, как известно, демонстрирует существенную цитотоксичность на различных клеточных линиях [24], но в случае покрытых гепарином агрегатов внешняя оболочка из полиэлектролита предотвращала появление выраженной токсичности, таким образом, делая такой агрегаты более перспективны с биомедицинской точки зрения.
Поскольку внешний слой агрегатов состоял из антикоагулянтной активности гепарина и способность инактивировать факторы антитромбина III (ATIII) измеряли с использованием анализа против Ха и сравнивали со свободным гепарином. Результаты показали, что как HPH, так и PPH были способны ингибировать ATIII зависимым от концентрации образом и показали активность 74% и 72% эквивалентного количества свободного гепарина соответственно. Чтобы определить антикоагулянтные свойства материалов, оценивали влияние наноагрегатов PPH и HPH на время тромбина (TT), время фибриногена (FT), время протромбина (PT) и время активированного частичного тромбопластина (aPTT) (Рисунок 3b). Можно видеть, что оба материала продемонстрировали антикоагулянтную активность, близкую к свободному гепарину. Для контрольной плазмы, обработанной свободным гепарином, HPH и PPH в терапевтической дозе 0,5 МЕ/мл, измеренные FT, PT и aPTT составляли >600 с, что указывает на сильную антикоагулянтную активность тестируемых соединений. Наблюдаемые результаты позволяют предположить, что магнитные агрегаты могут использоваться в качестве агента для антикоагулянтной терапии и могут быть магнитно отделены от плазмы перед инъекцией в организм или для анализа компонентов плазмы и будут подвергнуты дальнейшим исследованиям.
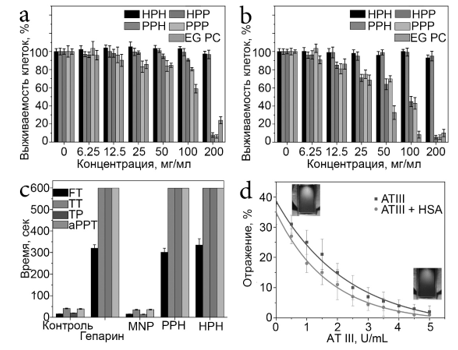
Рисунок 3: Цитотоксичность наноагрегатов на клетках HeLa через 24 (a) и 72 (b) часа, р <0,05; тесты на коагуляцию плазмы р <0,05 (c); зависимость интенсивности отражения от концентрации ATIII (d).
Сочетание фотонных свойств и биологической активности сделало агрегаты HPH пригодными для биосенсорных применений. Эта идея была подтверждена путем измерения интенсивности отражения системы в присутствии ATIII в различных концентрациях (рис. 4d). Аналогично, в случае антикоагулянтных свойств взаимодействие частиц, покрытых гепарином, с ATIII приводило к адсорбции последних на поверхности агрегатов, что приводило к изменениям гидродинамических свойств частиц, что препятствовало их способности образовывать упорядоченные периодические структуры и вызывало интенсивность спектров отражения. Аналитический сигнал показал обратную зависимость, изменяющуюся от 100% до 2% в диапазоне концентраций 0-5 Ед/мл с экспоненциальным законом затухания. Кросс-селективность системы в отношении ATIII была проверена в присутствии человеческого сывороточного альбумина (HSA), который является наиболее распространенным белком крови в плазме. В присутствии HSA чувствительность системы была почти на 20% ниже, но сохраняла характер зависимости от концентрации ATIII (рис. 4d). Эти свойства могут быть потенциально связаны с созданием новых типов биосенсоров для in vitro и in vivo обнаружения уровня ATIII.
Выводы
В этой статье мы впервые описали применение послойного метода для синтеза магнитных фотонных кристаллов быстрым и масштабируемым образом. Образовавшиеся агрегаты имели структуры ядро-оболочка с суперпарамагнитным ядром, состоящим из наночастиц магнетита, покрытых полиэлектролитными самоорганизующимися слоями. При постоянных условиях эксперимента гидродинамические параметры собранных систем, такие как гидродинамический диаметр, индекс полидисперсности и дзета-потенциал, зависели от значений pKa применяемых полиэлектролитов и могут варьироваться в широких пределах. Благодаря превосходной коллоидной стабильности и высоким значениям намагниченности системы гепарин-PDADMAC-гепарин и PSS-PDADMAC-гепарин способны образовывать магнитные фотонные кристаллы под воздействием внешнего магнитного поля. Спектры отражения таких систем зависели от напряженности приложенного магнитного поля и могут варьироваться в диапазоне от 720 до 445 нм в полях до 650 Гс. Синтезированные материалы могут найти свое применение в областях оптики, антикоагулянтов и т. Д. ¬апы или для создания фотонных биоаналитических систем. Агрегаты показали превосходную биосовместимость и не оказывали какого-либо цитотоксического действия на клеточные линии HeLa в концентрациях до 200 мкг / мл. Системы продемонстрировали антикоагулянтные свойства, сравнимые с эквивалентными количествами гепарина, и полностью ингибировали плазменную коагуляцию при концентрациях 0,5 МЕ / мл. Описанные магнитно-фотонные кристаллы могут быть использованы для измерения уровня ATIII или антикоагулянтной терапии.
Список литературы
- Wu, L.; Mendoza-Garcia, A.; Li, Q.; Sun, S. Organic phase syntheses of magnetic nanoparticles and their applications. // Chemical reviews 2016, № 116, С. 10473-10512.
- Giner-Casares, J. J.; Henriksen-Lacey, M.; Coronado-Puchau, M.; Liz-Marzan, L. M. Inorganic nanoparticles for biomedicine: where materials scientists meet medical research. // Materials Today 2016, № 19, С. 19-28.
- Xu, X.; Friedman, G.; Humfeld, K. D.; Majetich, S. A.; Asher, S. A. Superparamagnetic photonic crystals. // Advanced materials 2001, № 13, С. 1681-1684.
- Wei, Z.; Ujiiye-Ishii, K.; Masuhara, A.; Kasai, H.; Okada, S.; Matsune, H.; Asahi, T.; Masuhara, H.; Nakanishi, H. Synthesis and characterization of monodispersed polymer/polydiacetylene nanocrystal composite particles. // Journal of nanoscience and nanotechnology 2005, № 5, С. 937-944.
- Liu, J.; Mao, Y.; Ge, J. The magnetic assembly of polymer colloids in a ferrofluid and its display applications. // Nanoscale 2012, № 4, С. 1598-1605.
- Luo, W.; Ma, H.; Mou, F.; Zhu, M.; Yan, J.; Guan, J. Steric-Repulsion-Based Magnetically Responsive Photonic Crystals. // Advanced Materials 2014, № 26, С. 1058-1064.
- Ge, J.; Hu, Y.; Biasini, M.; Beyermann, W. P.; Yin, Y. Superparamagnetic magnetite colloidal nanocrystal clusters. // Angewandte Chemie International Edition 2007, № 46, С. 4342-4345.
- Liang, J.; Ma, H.; Luo, W.; Wang, S. Synthesis of magnetite submicrospheres with tunable size and superparamagnetism by a facile polyol process. // Materials Chemistry and Physics 2013, № 139, С. 383-388.
- Wang, W.; Tang, B.; Ju, B.; Zhang, S. Size-controlled synthesis of water-dispersible superparamagnetic Fe3O4 nanoclusters and their magnetic responsiveness. // RSC Advances 2015, № 5, С. 75292-75299.
- Fang, M.; Volotinen, T. T.; Kulkarni, S.; Belova, L.; Rao, K. V. Effect of embedding Fe3O4 nanoparticles in silica spheres on the optical transmission properties of threedimensional magnetic photonic crystals. // Journal of Applied Physics 2010, № 108, С.
- Hu, H.; Chen, C.; Chen, Q. Magnetically controllable colloidal photonic crystals: unique features and intriguing applications. // Journal of Materials Chemistry C 2013, № 1, С. 60136030.
- Ge, J.; Yin, Y. Magnetically tunable colloidal photonic structures in alkanol solutions. // Advanced materials 2008, № 20, С. 3485-3491.
- Shapovalova, O. E.; Drozdov, A. S.; Bryushkova, E. A.; Morozov, M. I.; Vinogradov, V. V. Room-temperature fabrication of magnetite-boehmite sol-gel composites for heavy metal ions removal. // Arabian Journal of Chemistry 2020, № 13, С. 1933-1944.
- Anastasova, E. I.; Ivanovski, V.; Fakhardo, A. F.; Lepeshkin, A. I.; Omar, S.; Drozdov, A. S.; Vinogradov, V. V. A pure magnetite hydrogel: synthesis, properties and possible applications. // Soft matter, 2017, № 13, С. 8651-8660.
- Vinogradov V. V. et al. Composites based on heparin and MIL-101 (Fe): the drug releasing depot for anticoagulant therapy and advanced medical nanofabrication //Journal of Materials Chemistry B. 2018. №. 16. С. 2450-2459.
- Drozdov, A. S.; Ivanovski, V.; Avnir, D.; Vinogradov, V. V. A universal magnetic ferrofluid: Nanomagnetite stable hydrosol with no added dispersants and at neutral pH. // Journal of colloid and interface science 2016, № 468, С. 307-312.
- Shebanova, O. N.; Lazor, P. Raman spectroscopic study of magnetite (FeFe2O4): a new assignment for the vibrational spectrum. // Journal of Solid State Chemistry 2003, № 174, С. 424-430.
- Pavlov, V.; Usachev, P.; Pisarev, R.; Kurdyukov, D.; Kaplan, S.; Kimel, A.; Kir- ilyuk, A.; Rasing, T. Enhancement of optical and magneto-optical effects in three-dimensional opal/Fe3O4 magnetic photonic crystals. // Applied physics letters 2008, № 93, С. 072502.
- Xuan, R.; Ge, J. Invisible photonic prints shown by water. // Journal of Materials Chemistry 2012, № 22, С. 367-372.
- Bizdoaca, E.; Spasova, M.; Farle, M.; Hilgendorff, M.; Caruso, F. Magnetically directed self-assembly of submicron spheres with a Fe3O4 nanoparticle shell. // Journal of Magnetism and Magnetic Materials 2002, № 240, С. 44-46.
- Wang, H.; Yu, Y.; Sun, Y.; Chen, Q. Magnetic nanochains: a review. // Nano 2011, № 6, С 1-17.
- Rayavarapu, R. G.; Petersen, W.; Hartsuiker, L.; Chin, P.; Janssen, H.; Van Leeuwen, F. W.; Otto, C.; Manohar, S.; Van Leeuwen, T. G. In vitro toxicity studies of polymer-coated gold nanorods. // Nanotechnology 2010, № 21, С.

