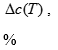Знание условий фазового равновесия углеводородов, воды и различных веществ, применяемых в процессах добычи, является основой разработки механизмов и методов увеличения величины извлекаемых запасов. Данный аспект подразумевает детальное исследование двухфазных и трехфазных систем, например, ПАВ – минерализованная вода – нефть, нефть – растворитель, пар – нефть – минерализованная вода. Для описания фазового равновесия углеводородных систем, при проектировании, разработке и эксплуатации месторождений применяют методы математического моделирования. При математическом моделировании парожидкостного равновесия нефтегазоконденсатных смесей выделяют три основных направления. Первое это графоаналитический метод, основанный на применении давления схождения. Втрое это комбинированный подход, основанный на применении уравнений состояния для описания свойств паровой фазы и теории регулярных растворов для коэффициентов активности компонентов смеси в жидкой фазе. Третье это применение единых уравнений состояния для описания свойств, сосуществующих равновесны фаз. Последний подход наиболее удобен, так как уравнения в аналитической форме содержат максимум информации о данной системе. Расчет фазового равновесия с использование уравнения состояния основан на строгом применении классических положений термодинамики многокомпонентных систем – равенств химически потенциалов (летучестей) компонентов смеси во всех сосуществующих фазах. Самым простым уравнением состояния является уравнение состояния идеального газа Менделеева — Клапейрона, но параметры реального газа аппроксимируются данным уравнением только при низких давлениях и высоких температурах. Поэтому были предложены различные уравнения состояния, в которых использовались модели газов, учитывающие силы межмолекулярного взаимодействия, уравнение Ван-дер-Ваальса. На практике применяют его модификации, так для описания поведения углеводородов используют предложенное Робинсон и Пенгом уравнение, которое имеет вид:
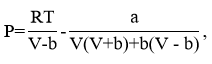
где R=0,0083144 МПа.м3/(кмоль.К) – универсальная газовая постоянная, коэффициенты уравнения для чистого вещества являются функциями критической температуры ![]() , критического давления
, критического давления ![]() и ацентрического фактора
и ацентрического фактора ![]()
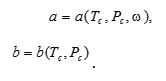
Для многокомпонентной смеси уравнение описывает поведение газа или жидкости, в гетерогенной области, а коэффициенты уравнения рассчитываются по правилам смешения:

где N – общее число компонентов смеси; i – номер компонента; ![]() – мольная доля i-го компонента в соответствующей фазе; Cij –коэффициенты парного взаимодействия i-го и j-го компонентов смеси, уточняющие правила смешения и введены главным образом для того чтобы, избежать перекрёстного взаимодействия и полярности между компонентами смеси и позволяют повысить точность расчетов фазового равновесия. Значения этих коэффициентов определяются различными алгоритмами [2] исходя из наилучшего совпадения расчетных и экспериментальных данных, могут быть отрицательными или положительными, но ограничены значением от -1 до 1. А.И. Брусиловским и Г.Р. Гуревичем рассчитаны коэффициенты парного взаимодействия для целого ряда компонентов, недостатком их работы является то, что коэффициенты, приведённые в их работе, полагаются постоянными [1]. Полученные различными исследователями результаты показывают существенное влияние температуры на значение коэффициента парного взаимодействия. В данной работе приводятся функциональные зависимости коэффициента парного взаимодействия азота с рядом углеводородов, полученные научным коллективом под руководством Ю.В. Калиновского Таблица 1.
– мольная доля i-го компонента в соответствующей фазе; Cij –коэффициенты парного взаимодействия i-го и j-го компонентов смеси, уточняющие правила смешения и введены главным образом для того чтобы, избежать перекрёстного взаимодействия и полярности между компонентами смеси и позволяют повысить точность расчетов фазового равновесия. Значения этих коэффициентов определяются различными алгоритмами [2] исходя из наилучшего совпадения расчетных и экспериментальных данных, могут быть отрицательными или положительными, но ограничены значением от -1 до 1. А.И. Брусиловским и Г.Р. Гуревичем рассчитаны коэффициенты парного взаимодействия для целого ряда компонентов, недостатком их работы является то, что коэффициенты, приведённые в их работе, полагаются постоянными [1]. Полученные различными исследователями результаты показывают существенное влияние температуры на значение коэффициента парного взаимодействия. В данной работе приводятся функциональные зависимости коэффициента парного взаимодействия азота с рядом углеводородов, полученные научным коллективом под руководством Ю.В. Калиновского Таблица 1.
Таблица 1.
Зависимости от температуры для коэффициента парного взаимодействия
|
Компо
-нент
|
Зависимость от температуры
|
Интервал температур, K
|
|
|
|
|
CO2
|
0,2089T2-0,944T+0,9516
|
[218,15-298,15]
|
16,15
|
7,71
|
52,26
|
|
H2S
|
-0,0085T2+0,0327T+0,1655
|
[200,15-344,15]
|
17,16
|
7,51
|
56,23
|
|
nC4H10
бутан
|
-0,08592T2+0,06053T-0,9662
|
[310,93-377,59]
|
18,29
|
18,29
|
–
|
|
iC4H10
изобутан
|
-0,6168T2+3,4402T-4,633
|
[255,37-310,37]
|
15,23
|
14,26
|
6,36
|
|
nC5H12
пентан
|
-0,1056T2+0,6294T-0,8296
|
[277,45-377,55]
|
8,51
|
8,12
|
4,58
|
|
iC5H12
изопентан
|
-0,0798T2+0,05233T-0,743
|
[277,59-377,04]
|
6,05
|
5,29
|
12,56
|
|
nC6H14
гексан
|
-0,0617T2+0,4326T-0,6088
|
[310,95-444,25]
|
13,37
|
12,37
|
7,47
|
|
nC7H16
гептан
|
-0,1082T2+0,7239T-1,0596
|
[313,6-433,0]
|
11,31
|
10,69
|
5,48
|
В Таблице 1 в первом столбце представлен компонент, во втором функция зависимости для относительной температуры (T/100), в третьем интервал температуры в котором определись функциональная зависимость, в четвертом относительная погрешность при постоянном значении коэффициента парного взаимодействия ![]() , в пятом относительная погрешности для переменного коэффициента парного взаимодействия
, в пятом относительная погрешности для переменного коэффициента парного взаимодействия ![]() , в шестом относительное погрешность между постоянным и переменном значением коэффициента парного взаимодействия
, в шестом относительное погрешность между постоянным и переменном значением коэффициента парного взаимодействия ![]() .
.
Из Таблицы 1 видно, что функциональная зависимость коэффициента парного взаимодействия от температуры для азота аппроксимируется кривой второго порядка. Анализ погрешностей показывает, что снижение относительных ошибок расчета существенен и в промышленных масштабах может привести к значительным энергетическим и экономическим потерям.
Использованные источники:
- Брусиловский А.И. – Фазовые превращения при разработке месторождений нефти и газа. – М. : Издательский дом «Грааль», 2002.
- Калиновский Ю.В., Пономарев А.И. – Двухфазные и трехфазные равновесия в газодобыче. – Уфа, 2006.