Введение
В современном мире трипаносомозы являются актуальной проблемой в сфере АПК (агропромышленного комплекса), а в частности коневодства, и даже успешное лечение не всегда способно полностью восстановить функциональные способности лошади, что в дальнейшем может привести к летальному исходу. К сожалению, это наносит огромный экономический ущерб фермерским хозяйствам, содержащим коневодство, за счет преждевременной выбраковки лошадей, заболеваемости и смерти новорожденных жеребят. Заболевание Су-ауру наиболее распространено в
Средней Азии и Южном Казахстане, так как контакт животных с насекомыми особенно велик в разгар засушливого сезона, что определяет сезонность заболеваемости трипаносомозом. Восприимчивы не только однокопытные, а также кошки и лабораторные животные (белые мыши и крысы, морские свинки и кролики). Болеют животные всех возрастов. Источник инвазии — больные и переболевшие, недолеченные животные, а также кровососущие насекомые.
Литературный обзор
Су-ауру – это сезонное природно-очаговое трансмиссивное острое чаще хроническое заболевание однокопытных, вызываемое трипаносомой
Tr. ninaekohl jakimovi или Тr. еvansi сопровождается лихорадкой возвратного типа (характеризуется чередованием периодов повышения температуры с периодами нормальной температуры, которые длятся несколько суток ), анемией, увеличением лимфатических узлов, истощением и параличами.
Trypanosoma evansi (Тr. ninaekohl jakimovi семейства Trypanosomatidae) по морфологическим признакам похожа на других трипаносом. Находится в плазме крови, ее размеры (20,9—32,0) х (1,4—2,9) мкм. У трипаносомы веретенообразная форма тела, передний конец заострен, задний округлен, напоминают бурав. Все трипаносомы морфологически сходны, тело их состоит их цитоплазмы, ядра, кинетопласта (базальное тело), ундулирующей мембраны и жгутика, который заканчивается в передней части тела. Движение паразита осуществляется на счёт жгутика и сокращения тела.
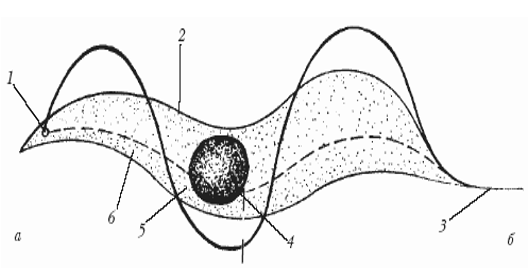
Схема строения трипаносомы:
а – хвостовой конец, б – головной конец; 1 – кинетопласт; 2 – пелликула; 3- жгутик; 4 – ядро; 5 – плотные включения; 6 – цитоплазма.
Переносчиками возбудителя является слепни рода Tabanus (только самки) и мухи-жигалки рода Stomoxys (самцы и самки). Передача возбудителей происходит механически, т.е. без какого-либо развития в организме насекомых. Трипаносомы легко проникают через поврежденные кожу и слизистые оболочки.
Размножение происходит на месте укуса, попадают в регионарные лимфатические узлы и распространяются по всему телу, которые в свою очередь вырабатывают антитела – трипанолизины, соединяясь с трипаносомами они их разрушают и лизируют, т.е. происходит отравление организма. Часть трипаносом может изменять антигенную структуру.
Инкубационный период длится от 1-3 недель, сопровождается лихорадкой рецидивирующего типа, а также отеками губ, щек, подчелюстного пространства, слизистые оболочки могут приобретать желтушный оттенок.
Патологические изменения характеризуются анемией паренхиматозных органов, увеличением лимфатических узлов, наличием серозной жидкости в брюшной и грудной полостях, а также точечными кровотечениями.
В лаборатории для исследования берутся тонкие кровяные мазки периферических сосудов из уха, хвоста и венчика от подозреваемого в заболевании животного или сердце, часть печени, селезенку, лимфатические узлы от павшего. Исследование крови в раздавленной капле можно проводить и в хозяйстве: на случную болезнь – взятие соскобов с примесью крови из различных мест слизистой оболочки влагалища, мочеиспускательного канала, сперму, экссудат из надрезов отеков и бляшек.
Соскобы из слизистой уретры берут специальной уретральной ложкой. При таком отборе проб без фиксации жеребца не обойтись. После фиксации вводят внутримышечно в области крупа рометар в дозе 7,5 куб.см на 100 кг массы тела. Через 7-10 мин вводят уретральную ложку на глубину 5-6 см и делает 3-4 возвратно-поступательных движения по стенке уретры. После извлечения уретральной ложки, материал помещают в пробирку со слабокислым физиологическим раствором, после чего плотно закрывают резиновой пробкой.
Для серологического исследования направляют 1-2 см³ сыворотки крови, нативной или консервированной 5%-ным раствором фенола или сухой борной кислотой (2-4% к объему); для биологического – гепаринированную (5 Ед гепарина на 1 куб.см крови) или центрированную (1 капля 6%-ного водного раствора лимоннокислого натрия на 1 куб.см крови).
Исследования
Исследование су-ауры проводится в лабораториях или на месте (в зависимости от ситуации). Материалом для исследования служат тонкие мазки крови, взятые из периферических сосудов уха, хвоста или венчика от подозреваемого в заболевании животного, или же берут органы и части органов (сердце, часть печени, селезенку, лимфатические узлы) от павшего животного.
Патологический материал доставляется в лабораторию в термосе со льдом не позднее чем через 4 ч, кровь и сыворотку – не позднее чем через 2 дней после приема.
При исследовании в хозяйстве каплю крови периферических сосудов наносят на предметное стекло, накрывают покровным и исследуют в раздавленной капле под средним увеличением микроскопа в затемненном поле зрения. Если в поле зрения видны живые трипаносомы с ундулирующей мембраной, значит животное больное.
При исследовании в лаборатории доставляют пробы цельной крови или ее сыворотки. Применяют методику по РСК.
Для дифференциальной диагностики случной болезни и су-ауру (при первом обнаружении трипанозом) делают прививку материала (крови или соскобов) лабораторным животным. Возбудителем су-ауру легко заражаются все лабораторные животные, возбудителем же случной болезни лабораторные животные заражаются в виде исключения и дальнейшая перепрививка болезни не удается.
Реакцию ставят в водяной бане в общем объеме 2,5 мл всех компонентов при температуре 37—38°.
Компоненты реакции:
а) гемолизин — рабочий титр не менее 1 :1000;
б) трипанозомный антиген;
в) комплемент — свежая, консервированная или сухая сыворотка крови морской свинки;
г) испытуемые сыворотки и сыворотки нормальная и позитивная, инактивированные в день постановки реакции при температуре 56—58° в течение 30 минут; сыворотки ослов и мулов инактивируют при 64° в течение 30 минут;
д) 2,5%-пая взвесь эритроцитов от осадка на физиологическом растворе (1 :40);
е) физиологический раствор (0,85%-ный раствор химически чистой поваренной соли в дистиллированной воде).
Титрование компонентов реакции. Перед реак-цией проводят титрование гемолизина и комплемента в гемолитической системе и комплемента на сыворотках.
Титрование гемолизина. При титровании гемолизина делают следующие разведения: 1 : 100 (основное разведение), 1 :500, 1 : 1000, 1 : 1500, 1 : 2000, 1 :2500, 1 : 3000.
Каждое разведение испытывают в дозе 0,5.
Если гемолизин консервирован карболовой кислотой, то берут 0.1 гемолизина на 9,9 физраствора (1 : 100); если же консервирован глицерином, то следует брать 0,2 гемолизина на 9,8 физраствора (обычно на биофабрике принято консервировать гемолизин глицерином).
Комплемент берут по 0,5 мл в разведении I : 20 и эритроциты 2,5%-ная взвесь из осадка по 0,5 мл. Взамен трипанозомного антигена и сыворотки лошади в пробирки прибавляют I мл физ-раствора. Время течения реакции Ю минут в водяной бане при 37—38°. При титровании гемолизина ставят следующие контроли:
* Из книги «Ветеринарное законодательство», Москва, 1959.
- I) гемолизина (т. е. гемолизин + эритроциты + физраствор до-объема 2,5 при отсутствии комплемента), 2) комплемента (т. е. комплемент + эритроциты + физраствор до объема 2,5 при отсутствии гемолизина) и 3) физраствора (т. е. эритроциты + физраствор до 2,5 при отсутствии гемолизина и комплемента).
Во всех контрольных пробирках гемолиз эритроцитов отсутствует.
Титр гемолизина — наименьшее количество его, потребное для полного гемолиза 0,5 мл взвеси эритроцитов при 0,5 комплемента в разведении 1:20, при температуре 37—38° в течение 10 минут.
Рабочим титром гемолизина для титрования комплемента, а также для реакции при испытании сывороток (главный опыт) берут удвоенный титр гемолизина. Для дальнейшей работы допускается смешивание растворов гемолизина и эритроцитов в одинаковых объемах (гемолитическая система), смесь ставят в термостат для сенсибилизации на 30 минут при 37°.
Титрование комплемента в гемолитической: системе. Комплемент исследуют с интервалами по 0,03 в следующих дозах: 0,1, 0,13, 0,16, 0,19, 0,22 и т. д.- до 0,49 из разведения 1 : 20 (см. схему титрования комплемента). В каждую пробирку вместо недостающего количества до объема 0,5 мл доливают физраствор (1-я пробирка — физраствор 0,4; 2-я-0,37 и т. д.).
Титром комплемента в гемолитической системе считают наи-меньшее количество его, потребное для полного гемолиза 0,5 мл взвеси эритроцитов при рабочем титре гемолизина в течение 10 минут в водяной бане при температуре 37—38°.
Подтитровка комплемента на сыворотках. Компоненты: трипанозомные позитивные сыворотки + + + + и ++, консервированные 0,5% карболовой кислоты (9 мл сыворотки + + 1 мл 5%-ного раствора карболовой кислоты на физрастворе) или 1% борной кислотой, две нормальные сыворотки той же давности, что и испытуемые.
Трипанозомные и нормальные сыворотки разливают в пробирки по 0,1 и добавляют 0,4 физраствора. Дозу комплемента (из основного разведения 1 : 20) берут на 2 интервала ниже против титра его в гемолитической системе; если титр комплемента в гемолитической системе 0,25, то начинают с 0,19. Во все пробирки вместо недостающего количества до 0,5 комплемента добавляют физраствор: в 1-ю пробирку — 0,31, во 2-ю — 0,28 и т. д. В первые ряды нормальных и трипанозомных сывороток разливают трипанозомный антиген в рабочем титре по 0,5 мл, во вторые ряды по 0,5 мл физраствора и ставят на 20 минут в водяную баню при 37°. Затем добавляют по 1 мл гемолитической системы и снова ставят в водяную баню на 15 минут при 37—38°.
Титр комплемента — минимальное количество его, потребное для полного гемолиза взвеси эритроцитов в пробирках с нормаль-ными сыворотками, с антигеном и без антигена и с трипанозомными без антигена, при соответствующей задержке гемолиза с трипанозомными сыворотками с антигеном.
Разведение комплемента для главного опыта,; Пример. Титр комплемента в бактериолитической системе 0,3 в; разведении 1:20, т. е. в каждой пробирке чистого комплемента со-держится 0,015 (0,3:20 = 0,015). Если в главном опыте имеется 100 пробирок, то следует 0,015×100=1,5 чистого комплемента и 48,5 физраствора.
Главный опыт. Инактивированные испытуемые сыворотки исследуют в дозе 0,1 и 0,05 мл. Контрольные пробы без антигена —только в дозе 0,1 мл. Если проводится массовое исследование, то можно проводить реакцию в одной пробирке с дозой сыворотки 0,1 с дополнительным исследованием всех сывороток, давших задержки гемолиза в дозах 0,1 и 0,05 мл. Остальные компоненты — в установленных титрах и объеме. Связывание протекает 20 минут и гемолизирование идет 15 минут.
Основные контроли главного опыта.
- Нормальные и положительные сыворотки с антигеном и без антигена в дозах 0,1.
- Антиген в рабочей дозе без сыворотки.
- Контроли гемолитической системы.
Оценка результатов реакции. Официальной диагностической дозой сыворотки, по которой дают результат (ответ), является 0,1. Доза 0,05 является вспомогательной — контрольной, и результаты, полученные с ней, оцениваются вдвойне крестами, например, ++ оценивается за + + + + ; + за ++ и т. д.
Результат реакции оценивают два раза: первый раз — тотчас после бани, второй — через 12 часов нахождения проб в спокойствии при комнатной температуре.
Результаты реакции отмечают крестами: ———————
Результат исследования сообщают словами: положительная, сомнительная и отрицательная с указанием крестов.
Полученные данные всех опытов титрования и особенности серологических реакций вносят в дневник серологических работ лаборатории. Для определения результатов реакции в процентах гемолиза поступают таким образом: из реакции выбирают 5 пробирок с полным гемолизом эритроцитов и жидкость сливают в одну пробирку. Эта жидкость соответствует 100% гемолиза. Из этой жидкости делают разведения с меньшим процентом гемолиза по схеме:
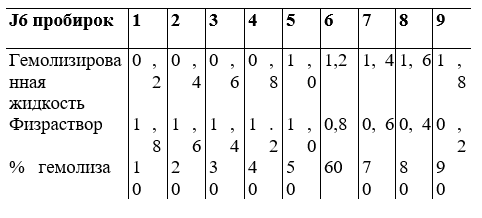
Шкалу используют в том случае, если эритроциты в пробирках главного опыта осели на дно. Оценивают путем сравнения цвета жидкости в пробирках со стандартной шкалой, а процент гемолиза переводят в кресты.
Одним из главных условий является свежесть сыворотки, максимум 1 или 2 дня после взятия. Сыворотки, подвергшиеся гемолизу, загнившие или проросшие непригодны для исследования. Сыворотки здоровых ослов при подтитровке комплемента на нормальных лошадиных сыворотках дают неспецифическую задержку гемолиза.
Наши исследования
Для исследования мы поехали в коневодческое хозяйство Московской области, дабы проверить восприимчивых животных — лошадей на наличие трипаносом. Нами были отобраны пробы крови из уха от 8 лошадей. После отбора проб на месте мы сделали тонкие мазки крови, и каждый из них внимательно рассмотрели в микроскопе, пройдясь по всем полям зрения.
По результатам нашего исследования мы составили таблицу.
|
Номер лошади |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Количество трипаносом в 1 поле зрения |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Количество трипаносом в мазке |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
Вывод
Су-ауру — трансмиссивное заболевание, падеж животных котором может достигать 12—50% и более. Меры борьбы должны проводиться комплексно с учетом всех факторов предрасполагающих к заболеванию, а также зоотехнические, зоогигиенические, ветеринарно-санитарные и хозяйственно-организационные мероприятия. Лечение этого заболевания наиболее эффективно на начальном этапе, перед тем как она переросла в хроническую форму, вызывающее ежегодные рецидивы, поэтому важно постоянно обследовать всех склонных к заражению животных, а также следить за состоянием здорового поголовья.
По результатам наших исследований трипаносомы в мазках не обнаружены, а это значит, что в хозяйстве Московской области нет лошадей, которые больны су-ауру. Это является результатом соблюдения мер предупреждения заболевания, таких как мониторинг состояния животных, своевременный уход и вакцинация.
Литература
1. Косминков Н.Е. Паразитология и паразитарные болезни сельскохозяйственных животных: Учебник//Косминков Н.Е., Лайпанов Б.К., Домацкий В.Н., Белименко В.В. – М.: НИЦ ИНФ Инфра-М, 2016.
2. Паразитология и инвазионные болезни сельскохозяйственных животных / К.И. Абуладзе [и др.]. – М.: Агропромиздат, 1990.
3. Паразитология и инвазионные болезни животных / М.Ш. Акбаев [и др.]. – М.: Колос, 2000.
4. Ятусевич А.И. Паразитология и инвазионные болезни животных: учебник для студентов специальности “Ветеринарная медицина” // А. И. Ятусевич, Н. Ф. Карасев, Якубовский М.В. // Под общ. ред. А. И. Ятусевича. 2007.
5.https://meduniver.com/Medical/Biology/504.html
6.https://www.sites.google.com/site/vetparazitologia/mikropreparati
7.https://studref.com/333225/agropromyshlennost/surra_auru_loshadey_verblyudov

