Введение
Электромиография (ЭМГ) – это комплекс методов оценки функционального состояния нервно-мышечной системы, основанный на регистрации и анализе электрической активности мышц [1]. Одним из методов электромиографии является поверхностная ЭМГ (пЭМГ). Суть этого метода заключается в установке на поверхность кожи нескольких электродов, между которыми измеряется разница электрических потенциалов. Фиксация разницы биопотенциалов в определенные моменты времени в течении некоторого периода формирует массив значений, образующий дискретно заданную функцию.
График функции ЭМГ сигнала обладает сложной, нестационарной структурой, состоящей из суммы осцилляций биопотенциалов в определенном интервале частот, а также посторонних шумов [2]. Исследуя его амплитудо-временные характеристики, можно сделать вывод о скорости сокращения мышцы или о развиваемом мышечном усилии в заданный момент времени.
Поверхностная электромиография используется для определения функционального состояние скелетных мышц и периферических нервов, что является простым и удобным методом для управления экзоскелетами, а также похожими по принципу работы и сферами применения активными протезами [3]. Исторически, первые протезы имели механический принцип управления, т.е на системах рычагов, тяг, шарниров, шестерней [4], движимых значительной мышечной силой. С появлением электродвигателей, использующих не мускульную силу, а внешний источник энергии, и микроконтроллеров, способных интеллектуально обрабатывать входные сигналы и формировать управляющие воздействия, появилась возможность создавать активные протезы конечностей, управляемые слабыми электрическими сигналами.
Кроме пЭМГ, существуют системы управления (СУ) на основе электроэнцефалографии (ЭЭГ) и механики (мышечная тяга, датчики угла поворота). Можно выделить следующие причины популярности и преимущества пЭМГ в качестве СУ бионических устройств: 1) простота и малогабаритность системы – пара электродов, усилитель, фильтр, контроллер для обработки данных; 2) управление с помощью привычного для человека способа – напряжения мышц; 3) В случае с механической СУ, необходимые мышцы и суставы могут просто отсутствовать, пЭМГ же позволяет снимать сигнал с любой удобной для управления мышцы; 4) малая зашумленность, по сравнению с ЭЭГ.
Постановка проблем
Один из главных недостатков пЭМГ – сложность поиска места на поверхности кожи, в котором установленные электроды будут снимать как можно более четкий и чистый от шумов сигнал.
В фундаментальной работе по поверхностной электромиографии [2] приводится формула из «теории трех слоев» (мышечного, жирового, кожного), выражающая значение ЭМГ потенциала на поверхности кожи для единичного мышечного волокна:
![]()
Здесь ![]() и
и ![]() – цилиндрические координаты;
– цилиндрические координаты; ![]() – волновое число;
– волновое число; ![]() и
и ![]() – электропроводности кожного слоя вдоль двух осей;
– электропроводности кожного слоя вдоль двух осей; ![]() – расстояние от мышечного волокна до точки измерения;
– расстояние от мышечного волокна до точки измерения; ![]() и
и ![]() – функции граничных условий;
– функции граничных условий; ![]() и
и ![]() – функции Бесселя, d – диаметр волокна.
– функции Бесселя, d – диаметр волокна.
Как можно увидеть, регистрируемый сигнал имеет очень сложную зависимость от антропометрических параметров тела человека – толщины жирового слоя, электропроводности кожи, и т.д. Это является одной из причин того, почему до 2000 года не существовало универсальных, стандартных рекомендаций по установке датчиков ЭМГ [5]. После, Европейской Ассоциацией SENIAM, на основании практических исследований, был выработан общий стандарт, определяющий наиболее практичное расположение электродов [6].
Однако, никакие стандарты не могут быть применены к исследованию мышц ампутационной культи, образованной после операции, так как после отрезания части конечности, остатки мышцы закрепляется на произвольном участке культи, формируя в итоге уникальную по сравнению с нормальными конечностями структуру [7]. Кроме того, мышцы, которые после ампутации утратили свое предназначение и перестали использоваться, атрофируются, что непредсказуемым образом влияет на возможность снятия ЭМГ сигналов.
Для нахождения приемлемого места для установки электродов на культю, сегодня используется самый распространенный, традиционный метод – электроды закрепляют на поверхности кожи в определенной точке, затем пациент напрягает мышцу, производится измерение. В случае неудовлетворительных параметров сигнала, электроды снимают и устанавливают в другое место, в надежде найти нормальное положение. Такой анализ занимает много времени, требует постоянных манипуляций специалистом. Главный минус же в том, что этот метод занимает длительный промежуток времени и дает маленькую объективность при нахождении наилучшего места, поскольку не обеспечивает исследователя одновременной информацией о ЭМГ сигналах на всей поверхности культи.
Проблемой другого рода можно назвать отсутствие цифровой модели, позволяющей исследовать и хранить информацию на компьютере, а также отображающей точное расположение датчиков для изготовления культеприемных гильз, печатаемых на 3D принтере. Исследование [8] показывает, что печатаемые гильзы оцениваются носителями как более удобные, по сравнению с изготавливаемыми традиционно. Это одно из преимуществ цифровых методов анализа и производства. С другой стороны, опрос небольшой выборки компаний, изготавливающих протезы, показал, что только 25% из них используют системы автоматизированного проектирования (САПР) [9]. Можно сделать вывод, что в целом отрасли характерно использование устаревших методов как исследования культи, так и производства устройств креплений.
В ходе анализа можно предположить следующие проблемы отрасли:
1) Отсутствие метода, дающего полную информацию о электромиографических сигналах на поверхности всей культи, позволяющего найти лучшее расположение мио-датчика.
2) Отсутствие метода построения цифровой модели культи, предназначенной для исследования на компьютере и улучшении подхода к созданию кастомизированного производства гильз, то есть под конкретного пользователя с учетом его антропометрических особенностей со встроенными ЭМГ датчиками.
Концепция решения
Основная идея, позволяющая избежать недостатков традиционного метода – построение цифровой 3D модели культи, на которой отображаются параметры ЭМГ сигналов во множестве точек на ее поверхности. Этот процесс можно разбить на несколько шагов: 1) аппроксимация формы поверхности, получение облака точек; 2) измерение ЭМГ сигналов в каждой требуемой точке, анализ сигналов; 3) преобразование облака точек с соответствующими параметрами в 3D модель культи, на которой удобно отображена полная карта информации об ЭМГ-сигналах.
При проектировании системы измерения поверхностных потенциалов возникают следующие сложности: 1) необходима система аппроксимации поверхности культи для построения облака точек; 2) необходимо устройство, которое будет автоматически измерять потенциалы с помощью касаний о поверхность культи; 3) на качество измерений ЭМГ при управлении протезом влияет давление гильзы на культю [10], зависящее от жесткости тканей культи и воздействия на нее гильзы.
Изложенные выше сложности дают понять, что необходимо комплексное решение, объединяющее в себе не только систему измерения ЭМГ потенциалов, но также систему измерения формы культи и степени жесткости ее тканей. Поэтому предполагается объединить данную систему с разрабатываемым устройством автоматизированного анализа культи «BioSculptor» (рисунок 1). Данное устройство ранее разрабатывалось авторами как устройств получение точной 3D культи пациента.
Устройство представляет из себя подвижную опору, на которой установлен продольный привод, сдвигающий круглую пластину с центральным отверстием. По кругу установлены восемь измерительных модулей, состоящих из линейного привода, тензометрического датчика, датчика касания, а также ЭМГ сенсора.

Рисунок 1 – Автоматизированный анализатор культи «BioSculptor»
Алгоритм работы устройства с системой измерения ЭМГ выглядит следующим образом:
1) Культя кладется на опору и надежно фиксируется, запуск устройства.
2) Линейные приводы выдвигаются до тех пор, пока не коснутся культи. Производится замер радиус-вектора от центральной оси анализатора до поверхности культи в данной точке.
3) Линейные приводы продолжают движение, оказывая давление на поверхность культи. Превышение предельного усилия отслеживается с помощью тензодатчика. Разница между положением привода в момент касания и в момент достижения предельного усилия представляет собой величину деформации тканей, по которой определяется жесткость поверхностных тканей в данной точке.
4) При нулевом усилии происходит замер ЭМГ сигнала в течении заданного времени.
5) Возврат приводов в нулевое положение. Если не достигнут конец культи, смещение продольного привода на фиксированное значение шага, возврат к пункту 2 (цикл).
6) После достижения конца культи создается 3D модель, устройство выключается.
Пример полученного первичного результата работы анализатора изображен на рисунках 2а, 2б, 2в. На рисунке 2а показана модель, полученное после объединения облака точек в группы полигонов. Рисунок 2б изображает модель после обработки методом конечных элементов и аппроксимации поверхности, разбивая ее на зоны. На рисунке 2в показана итоговая модель, на зоны которой наложена цветовая карта, отображающая определенные величины параметров ЭМГ сигналов. К примеру, это может быть карта максимальных значений амплитуды, позволяющая сделать вывод о мощностях сигналов.
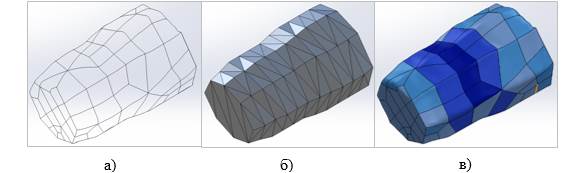
Рисунок 2 – Пример результата обработки данных анализа сегмента культи
Заключение
Анализ современных методик ЭМГ-исследований в области протезирования показал их малую информативность, нетехнологичность, а также сложность при использовании данных исследования для проектирования культеприемных гильз.
В качестве решения данных проблем, была предложена система комплексного электромиографического анализа, дающая информацию о ЭМГ сигналах на всей поверхности культи. Также, преимуществом системы является цифровой вывод в виде 3D модели, позволяющей быстро и удобно исследовать результаты измерений. Система предназначена для упрощения труда протезистов, увеличения информативности ЭМГ-исследований, повышения точности проектирования гильз протезов.
Недостатками системы можно считать сложность при измерении потенциалов на конце культи, а также плавающая сила, действующая на культю со стороны ЭМГ-датчиков, которая будет вносить вклад в погрешность измерений. Дальнейшая работа над системой будет посвящена рассмотрению данных вопросов и решения сопряженных проблем.
Литература:
1. Электромиография: клинический практикум / С. Г. Николаев. – 2-е изд., испр. и доп. – Иваново : ПресСто, 2019. – 392 с; ISBN 978-5-9909171-1-8
2. Merletti, Roberto & Farina, D.. (2016). Surface Electromyography: Physiology, Engineering and Applications. 10.1002/9781119082934.
3. Н.Н. Рукина, А.Н. Кузнецов, В.В. Борзиков, О.В. Комкова, А.Н. Белова Метод поверхностной электромиографии: роль и возможности при разработке экзоскелета (обзор) // Соврем. технол. мед.. 2016. №2. URL: https://cyberleninka.ru/article/n/metod-poverhnostnoy-elektromiografii-rol-i-vozmozhnosti-pri-razrabotke-ekzoskeleta-obzor (дата обращения: 13.12.2019).
4. Горохова Н.М., Головин М.А., Чежин М.С. Методы управления протезами верхних конечностей // Научно-технический вестник информационных технологий, механики и оптики. 2019. №2. URL: https://cyberleninka.ru/article/n/metody-upravleniya-protezami-verhnih-konechnostey (дата обращения: 13.12.2019).
5. Sacco, Isabel & Gomes, Aline & Otuzi, Mitie & Pripas, Denise & Onodera, Andrea. (2009). A method for better positioning bipolar electrodes for lower limb EMG recording during dynamic contractions. Journal of neuroscience methods. 180. 133-7. 10.1016/j.jneumeth.2009.02.017.
6. Recommendations for sensor locations on individual muscles // The SENIAM project: European concerted action in the Biomedical Health and Research Program (BIOMED II) of the European Union. URL: http://www.seniam.org (дата обращения: 13.12.2019).
7. Иванова В.Д., Колсанов А.В., Миронов А.А., Яремин Б.И. Ампутации. Операции на костях и суставах: Учебное пособие для студентов медицинских вузов. – Самара, 2013 – 176 с.
8. Karakoç, Mehmet & Batmaz, Ibrahim & Sariyildiz, Mustafa & Yazmalar, Levent & Aydın, Abdulkadir & Em, Serda. (2017). Sockets Manufactured by CAD/CAM Method Have Positive Effects on the Quality of Life of Patients With Transtibial Amputation. American journal of physical medicine & rehabilitation. 96. 10.1097/PHM.0000000000000689.
9. Petron, A.J. (2016). From a multi-indenter device for in vivo biomechanical tissue measurement to a quasi-passive transtibial socket interface. (PhD dissertation) // URL: https://dspace.mit.edu/handle/1721.1/106068 (дата обращения: 31.03.2019)
10. Hong, Jung & Mun, Mu. (2005). Relationship between socket pressure and EMG of two muscles in trans-femoral stumps during gait // Prosthetics and orthotics international. 29. 59-72.

